
Tecnologías que afectan nuestra vida: Diagnóstico genético preimplantacional
Por Diana Bernal
Para muchas personas, en algún momento de la vida llega el deseo de querer tener un hijo. En la mayoría de parejas heterosexuales, este evento ocurre de manera natural. Sin embargo, para un 10% de las mujeres que conforman esas parejas, no ocurre de forma natural (Boivin et al. 2007; Mascarenhas et al. 2012). Aunque la prevalencia de infertilidad en hombres no está estimada claramente (WHO http://www.who.int/reproductivehealth/topics/infertility/burden/en/), es claro que para algún porcentaje de los hombres, el tener un hijo tampoco ocurre de forma natural. Del total de parejas que encuentran dificultades para concebir un hijo, una tercera parte se debe a problemas en el hombre, otra tercera parte a problemas en la mujer, y la otra tercera parte a problemas tanto en el hombre como en la mujer o no se puede determinar la razón (http://resolve.org/infertility-101/what-is-infertility/fast-facts/ ). Afortunadamente existen tratamientos que pueden solucionar algunos casos de infertilidad, gracias a la detallada comprensión que tenemos hoy en día del fenómeno natural que culmina en la concepción de un bebe, y de fascinantes avances científicos y tecnológicos que permiten aplicar estos tratamientos, cada vez con mayores tazas de éxito.
Causas de la infertilidad
La infertilidad comúnmente se define como la incapacidad de una pareja para llevar un embarazo a término después de haber tenido relaciones sexuales durante un año sin uso de anticonceptivos. Hay casos en los que nunca ocurre el embarazo, mientras que en otros casos sí hay embarazo, pero se presenta un aborto. Hay muchas posibles causas de infertilidad. Estas pueden ser desde defectos en los aparatos reproductivos, como por ejemplo oclusión de los tubos de Falopio o malformaciones uterinas en las mujeres, o varicocele u obstrucción de los conductos deferentes en los hombres; pasando por factores ambientales como tratamientos de patologías graves, como cáncer, que resultan en la perdida no deseada de la capacidad de reproducción; hasta defectos genéticos, como algunos que disminuyen la capacidad de los espermatozoides de llegar hasta el ovulo, o resultan en la formación de un embrión no viable. Dependiendo de la causa, hay diferentes opciones que pueden ayudar a una pareja a concebir un hijo, desde cirugías que corrijan malformaciones, inseminación artificial, o fertilización in vitro. En los casos en que los padres tienen defectos genéticos que están en riesgo de transmitir a sus hijos, la fertilización in vitro puede ser complementada por el diagnóstico genético preimplantacional (DGP) para elegir embriones sin el defecto genético antes de implantarlos en el útero materno (Carl et al. 2010).
Algunos casos de infertilidad son causados por defectos genéticos que aumentan la cantidad de embriones no viables que produce una pareja, y en consecuencia la mayoría de embarazos no llegan a término. Además, existen parejas que están en alto riesgo concebir un bebe con una enfermedad grave e incurable debido a que son portadores de mutaciones genéticas que no afectan a los padres, pero que si afectarían a la progenie si heredan dichas mutaciones graves de ambos padres. En estos casos es ideal poder hacer un diagnóstico genético pre-implantacional, para identificar los embriones que presentan las mutaciones graves. De esta forma se pueden elegir los embriones que no recibieron las mutaciones graves para implantar en el útero materno, y así evitar el sufrimiento y riesgos físicos producidos por un aborto, o evitar enfrentarse a la decisión de continuar con un embarazo a sabiendas de que el bebe tendrá una enfermedad grave, o decidir terminar un embarazo planeado y deseado. Por lo tanto, para poder hacer un diagnóstico pre-implantacional es indispensable llevar a cabo la fertilización fuera del útero, es decir in vitro, para poder realizar el examen de diagnóstico al embrión antes de implantarlo en el útero materno. Así la fertilización in vitro es una tecnología indispensable para poder llevar acabo un DGP.
¿Qué condiciones genéticas se pueden detectar con el DGP?
El DGP puede detectar muchísimas condiciones genéticas, sin embargo, las recomendaciones internacionales incluyen solo ciertas condiciones, buscando evitar el uso del DGP para seleccionar condiciones ventajosas, y limitarlo a evitar tres situaciones: (1) la implantación de embriones no viables, (2) la implantación de embriones que producirán enfermedades graves e incurables, o (3) para ayudar a otro ser humano (Carl et al. 2010). En la primera situación, ósea para evitar la implantación de embriones no viables, un ejemplo claro es el caso de abortos recurrentes, una situación muy dolorosa para las parejas que los sufren; el 88% de los casos de abortos recurrentes se han podido solucionar al hacer una caracterización de todos los cromosomas del embrión, y trasplantando al útero solo embriones que no muestren ninguna alteración cromosómica (https://www.ccrmivf.com/services/recurrent-miscarriage/). En la segunda situación, ósea para evitar la implantación de embriones con defectos genéticos que producirían una enfermedad grave en el bebe por nacer, el DGP se usa para diagnosticar si el embrión presenta alteraciones en el numero o estructura de cromosomas, como puede ocurrir en la descendencia de padres con translocaciones cromosomales o de edad avanzada. O si el embrión presenta trastornos genéticos simples como la fibrosis cística o la enfermedad de Huntington. O el DGP se usa para detectar el sexo del bebe, para seleccionar un sexo determinado en los casos de familias con trastornos genéticos ligados al sexo, o para equilibrar una familia según la preferencia de los padres- pero solo en Estados Unido, ya que esto es ilegal en India, China, Canadá, Australia y Europa. Finalmente, en la última situación, el DGP se usa para determinar el tipo de complejo de histocompatibilidad antígeno, en los casos en que se necesitan células hematopoyéticas para un hermano ya nacido que necesite trasplante de medula ósea (Carl et al. 2010).
¿Cómo funciona el diagnóstico genético preimplantacional (DGP)?
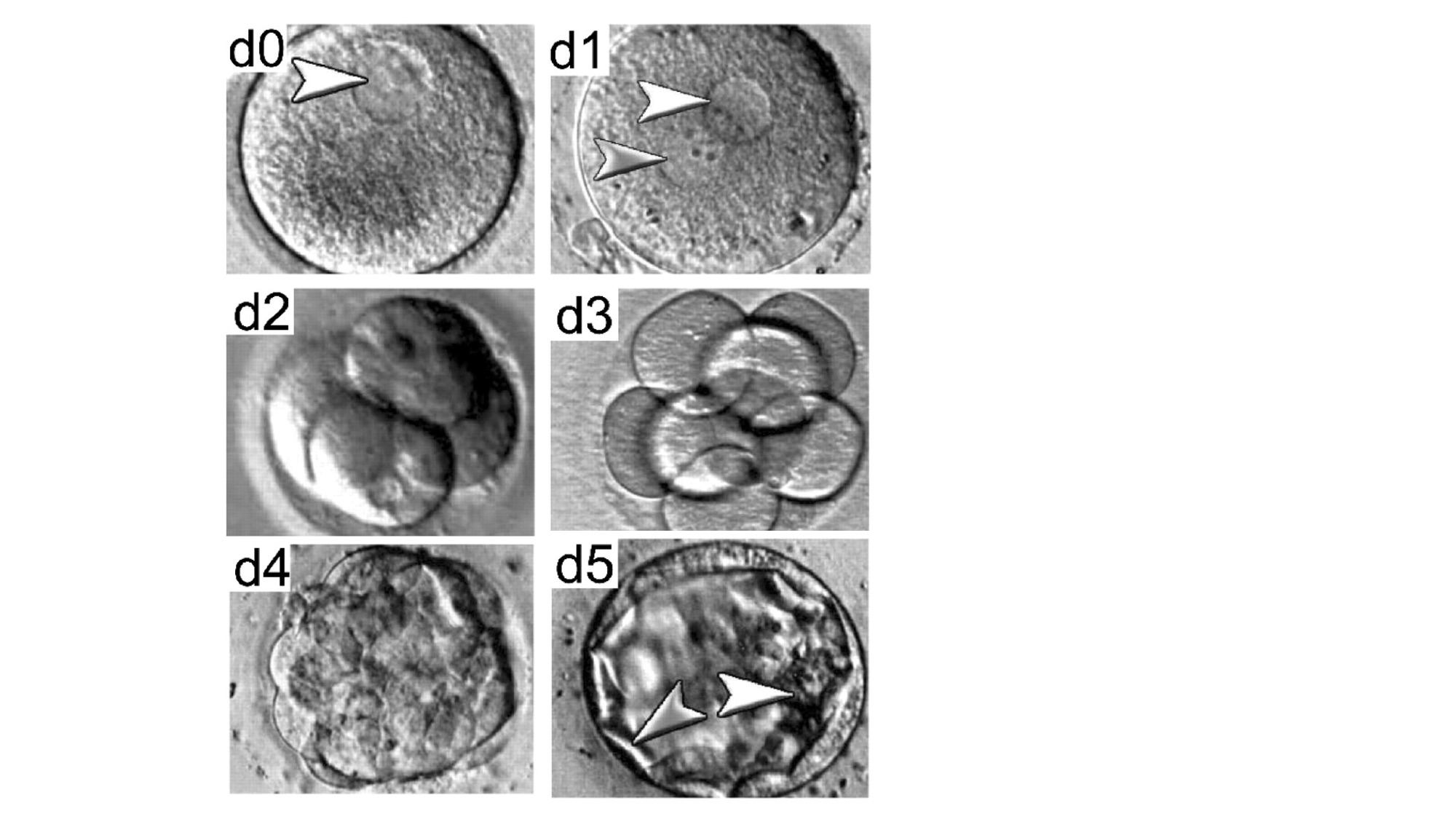
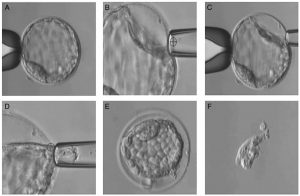
El DGP requiere comenzar por la fertilización in vitro para producir un embrión fuera del útero materno. L a probabilidad de éxito de la fertilización in vitro depende del número de óvulos disponibles para fertilizar. Por esto, el proceso comienza con la estimulación hormonal de la futura madre para que madure varios óvulos, seguido por la extracción de los óvulos maduros y obtención de los espermatozoides del futuro padre, que puede obtenerse por masturbación o aspiración, en caso de defectos que impidan la salida de los espermatozoides en el semen. Después se ponen en contacto físico los óvulos y espermatozoides para que el espermatozoide penetre el ovulo y una su material genético con el del ovulo, lo que da origen a un zigoto. El zigoto empieza a dividirse, y unos 5 días después, cuando el zigoto se ha convertido en una blástula (Figura 1), se hace una biopsia del embrión (Niakan et al. 2012), que consiste en abrir un pequeño hueco en la membrana que rodea el embrión y sacar una o dos células de la blástula (Capalbo et al. 2014), como se muestra en la Figura 2. La muestra es analizada con el método de diagnóstico genético más adecuado.
Figura 1. Desarrollo del embrión desde la etapa de la formación del zigoto después de la fertilización en el día 0 (d0), pasando por la etapa de mórula en el día 4 (d4), hasta llegar a la etapa de blástula en el día 5 (d5). La blástula contiene la masa celular interna (flecha blanca) que dará origen al embrión, y el trofoblasto (flecha gris) que dará origen a tejidos extra embrionarios como la placenta. En el dia 5 se toma una biopsia, como se ve en la Figura 2, para someter al análisis genético preimplantacional. Figura reproducida de (Niakan et al. 2012), con permiso de los autores.
Figura 2. Biopsia de blástula para obtener muestra para hacer DGP. (A) Blástula posicionada en pipeta de sostén, mostrando masa celular interna a las 7. (B y C) Pipeta de biopsia introduciendo líquido para separar células del trofoblasto. (D) Células separadas son aspiradas por la pipeta de biopsia mientras varios pulsos suaves de láser, apuntados por la cruz, desconectan las células aspiradas del embrión. (E) Blástula después de retirar biopsia. (F) Células tomadas en la biopsia. Figura reproducida de (Capalbo et al. 2014), con permiso de los autores.
Mientras se obtienen los resultados del diagnóstico genético, es necesario criopreservar los embriones para detener su desarrollo por fuera del útero materno. Una vez obtenidos los resultados se elige el embrión a trasplantar y se retira del estado de criopreservación para trasplantarlo al útero materno en el momento adecuado del ciclo de la mujer para que coincida con los días del ciclo en que es receptiva a un embrión.
Criopreservación
La necesidad de criopreservar los embriones abre varias posibilidades que hay que evaluar antes de llevar a cabo el proceso. Por una parte, es muy conveniente que se puedan guardar embriones, ya que en caso de que la implantación no sea exitosa sería posible intentar implantar otro embrión, sin tener que llevar a acabo todo el proceso desde la estimulación hormonal de la madre. Sin embargo, el proceso de criopreservación puede afectar la viabilidad de un embrión después de ser descongelado. Por otro lado, en caso de que algo imprevisto sucediera es necesario decidir previamente que se debe hacer con los embriones. Por ejemplo, que se debe hacer con embriones criopreservados si alguno de los padres muere, o si los padres deciden divorciarse. En el caso de la ausencia de uno de los dos padres, las posibles opciones son que el otro padre sea declarado total dueño y con poder de decisión de qué hacer con los embriones, o que se determine que los embriones se deben descongelar y descartar. En el caso de divorcio, las posibilidades son que los embriones se descongelen y descarten, que sean donados con fines de investigación científica -como investigación en células madre totipotenciales- la cual puede resultar en la destrucción de los embriones, pero no en el nacimiento de un bebe a partir de los mismos, o que una corte conceda el derecho a que los embriones si se usen para a un embarazo para uno de los padres, o sean donados para un embarazo para otra pareja. Finalmente, los espermatozoides y embriones que no sean utilizados durante el proceso, debido a que sean inmaduros o anormales y no sea posible usarlos, pueden ser utilizados con fines de entrenamiento de personal técnico antes de ser descartados.
¿Qué probabilidades de llegar a un embarazo exitoso ofrece el (DGP)?
La probabilidad de que el proceso completo termine en un embarazo que llegue a término, y que el bebe recién nacido no presente la condición que se buscaba evitar con el PDG depende de muchos eventos a lo largo de todo el proceso, y de las características específicas de los padres, por ejemplo, de la a edad y estado de salud, y de la condición genética que se busca aliviar. En cuanto a las probabilidades de éxito del proceso de fertilización in vitro, estas dependen del número de óvulos que se obtienen tras la estimulación hormonal. Generalmente se obtienen 8 ovocitos por ciclo de estimulación. Durante el siguiente proceso, que es la fertilización in vitro en sí, también depende de condiciones específicas, como por ejemplo de los espermatozoides. En el caso de los espermatozoides normales, se utilizan unos miles de espermatozoides por ovulo, y simplemente se dejan juntos en un medio de cultivo especial toda una noche, y se revisa al día siguiente cuales óvulos fueron fertilizados. 75% de óvulos fecundados de esta manera se fecundan correctamente. En el caso de que los espermatozoides tengan defectos morfológicos o de movilidad, se utiliza una técnica llamada “inyección intracitoplasmatica de esperma”, la cual consiste en tomar un solo espermatozoide normal e introducirlo al citoplasma del ovulo (que es simplemente toda la parte interna del ovulo) por medio de una inyección. En promedio, este proceso tiene un 60-70% de éxito.
Una vez se obtiene el zigoto, la mayoría llegara al estado de blástula (la figura 1 muestra que es una blástula), y las probabilidades de éxito del diagnóstico genético dependen de la condición especifica que se necesite diagnosticar. Cabe anotar que hay casos en los que se necesitan diseñar herramientas genéticas específicas para poder realizar el diagnostico, lo cual puede tomar entre 3 y 6 meses, o puede también suceder que no sea posible hacer un diagnóstico confiable, y el laboratorio de diagnosis puede negarse a realizar el diagnostico. Finalmente, cuando se hace un diagnóstico y se procede a una implantación en el útero, es muy importante entender que ningún método de diagnóstico es 100% inequívoco, y se debe hacer un examen para confirmar el diagnóstico una vez se alcance el embarazo, como análisis de líquido amniótico.
Perspectivas a futuro
La primera vez que le DGP fue utilizado como parte de un tratamiento para llevar un embarazo a término fue en 1990 (Handyside et al. 1990). Desde entonces, no solo ha servido para diagnosticar condiciones genéticas en embriones, si no para aumentar las probabilidades de éxito de los tratamientos para aliviar casos de infertilidad (Simpson 2010). En el 2001 se estima que había un poco más de 3000 casos clínicos en los que se usó DGP, y unos 40 centros en el mundo donde se realizaba este proceso (Robertson 2003). Para el 2006, los casos clínicos habían aumentado inmensamente, llegando a 15000 (Dayal and Athanasiadis 2015), lo que refleja el mejoramiento de la técnica en todos sus aspectos, en cuanto a la seguridad de la misma y las condiciones genéticas que puede diagnosticar. El DGP Es una tecnología que ha permitido a muchas parejas tener hijos sanos, que de otra manera no lo lograrían, por lo que está totalmente justificada en estos casos. Sin embargo, abre la posibilidad de seleccionar embriones antes de implantarlos según criterios diferentes a los que permiten aliviar problemas de infertilidad o de prevenir enfermedades graves, a poder seleccionar embriones con características específicas obedeciendo a otros objetivos. Aunque el DGP es la alternativa más fuerte frente a la prevención de enfermedades a través de modificar genéticamente la línea germinal –es decir modificar las células que van a dar origen a la progenie- porque precisamente permite identificar embriones que transmitirán enfermedades graves a siguientes generaciones y no implantarlos, evitando así la necesidad de modificar la línea germinal para evitar condiciones graves, irónicamente el DGP es también una de las tecnologías que podría permitir modificar la línea germinal, ya que una vez se haya aplicado un proceso para hacer una modificación genética deseada, es necesario verificar que la modificación haya ocurrido de la manera esperada, lo cual se podrá llevar acabo haciendo un diagnóstico genético preimplantacional.
Referencias
Boivin, Jacky, Laura Bunting, John A. Collins, and Karl G. Nygren. 2007. “International Estimates of Infertility Prevalence and Treatment-Seeking: Potential Need and Demand for Infertility Medical Care.” Human Reproduction 22 (6): 1506–12. doi:10.1093/humrep/dem046.
Capalbo, Antonio, Laura Rienzi, Danilo Cimadomo, Roberta Maggiulli, Thomas Elliott, Graham Wright, Zsolt Peter Nagy, and Filippo Maria Ubaldi. 2014. “Correlation between Standard Blastocyst Morphology, Euploidy and Implantation: An Observational Study in Two Centers Involving 956 Screened Blastocysts.” Human Reproduction 29 (6): 1173–81. doi:10.1093/humrep/deu033.
Carl, B, Eduardo C Lau, Marleen M Janson, Mark R Roesler, Peter Vantuinen, David P Bick, and Estil Y Strawn. 2010. “Preimplantation Genetic Testing : Current Status and Future Prospects.”
Dayal, Molina, and Ioanna Athanasiadis. 2015. “Preimplantation Genetic Diagnosis.” Medscape. doi:10.1097/GCO.0b013e32835faafe.
Handyside, A. H., E. H. Kontogianni, K. Hardy, and R. M. L. Winston. 1990. “Pregnancies from Biopsied Human Preimplantation Embryos Sexed by Y-Specific DNA Amplification.” Nature 344 (6268): 768–70. doi:10.1038/344768a0.
Mascarenhas, Maya N., Seth R. Flaxman, Ties Boerma, Sheryl Vanderpoel, and Gretchen A. Stevens. 2012. “National, Regional, and Global Trends in Infertility Prevalence Since 1990: A Systematic Analysis of 277 Health Surveys.” PLoS Medicine 9 (12): 1–12. doi:10.1371/journal.pmed.1001356.
Niakan, K. K., J. Han, R. A. Pedersen, C. Simon, and R. A. R. Pera. 2012. “Human Pre-Implantation Embryo Development.” Development 139 (5): 829–41. doi:10.1242/dev.060426.
Robertson, John A. 2003. “Extending Preimplantation Genetic Diagnosis: The Ethical Debate: Ethical Issues in New Uses of Preimplantation Genetic Diagnosis.” Human Reproduction 18 (3): 465–71. doi:10.1093/humrep/deg100.
Simpson, Joe Leigh. 2010. “Children Born after Preimplantation Genetic Diagnosis Show No Increase in Congenital Anomalies.” Human Reproduction 25 (1): 6–8. doi:10.1093/humrep/dep428.




Comentarios