
Treinta y cinco años han pasado desde que los primeros casos del Síndrome de Inmunodeficiencia Adquirida (SIDA) fueron detectados. Actualmente existen 36.9 millones de personas (casos reportados) incluyendo 2.6 millones de niños que viven con esta enfermedad en el mundo [1].
A principios de los años 80 el SIDA fue detectado por primera vez en los Estados Unidos [2]. Sin embargo, el virus que ataca las células de defensa de los humanos produciendo este síndrome, conocido como VIH (virus de inmunodeficiencia humana), se habría originado 60 años atrás, en lo que actualmente se conoce como República Democrática del Congo [3]. En 1999, investigadores de Estados Unidos, el Reino Unido y Francia encontraron un virus en chimpancés denominado virus de inmunodeficiencia en simios (VIS), que era el pariente más cercano del VIH, estableciendo que el virus posiblemente había pasado de los chimpancés a los humanos [4]. Aunque no existe una teoría totalmente aceptada de cómo dicho virus logró romper la barrera entre las dos especies, la explicación más aceptada es que posiblemente los simios fueron cazados y su carne infectada por el virus fue consumida por los humanos.
La patogénesis del virus era confusa, y a principio de la década de los 80, cuando se dieron los primeros casos, la sintomatología apuntaba a que la gente estaba muriendo de todo tipo de enfermedades desde cáncer hasta neumonía [5], y debido a una incidencia inicial en la comunidad gay, se creía que la enfermedad era un problema de homosexuales exclusivamente. Esto ocurrió hasta la mitad de 1982 cuando la enfermedad fue reportada en gente heterosexual con hemofilia y personas en Haití [6,7].
Era precisamente la ausencia de conocimiento del virus y de cómo actuaba una vez invadía el organismo, lo que no permitía entender la enfermedad. Sin embargo, luego de que el virus fue aislado en 1983 [8,9], se empezó a elucidar que el virus atacaba las células que precisamente nos defienden de las enfermedades. Esto explicaba por qué la gente moría incluso de enfermedades que habían sido controladas por la medicina moderna por décadas, por qué el virus infecta y destruye las células que en teoría nos ayudan a controlarlo y de paso destruye nuestras defensas contra otras enfermedades.
El VIH no solo puede generar millones de copias cada día al infectar las células de defensa, sino que también tiene una alta tasa de cambios en su genoma cada vez que se reproduce [10,11]. Esto le permite al virus generar resistencia ante los diferentes tratamientos que se utilizan contra él. El genoma es similar a un centro de control de instrucciones para que la célula funcione y tenga una estructura específica; todos tenemos este centro de control y a veces se efectúan pequeñas modificaciones en las instrucciones, pero el aspecto y función general de nuestras células no cambian mucho. Sin embargo en los virus, el centro de control permite más cambios de lo usual para que la estructura del virus se modifique lo suficiente de modo que los mecanismos de defensa y las drogas no puedan atacarlo. En otras palabras las drogas diseñadas para atacar un virus específico hoy, pueden no servir mañana pues el virus ya no se ve igual.
Esto no ha impedido que se siga trabajando arduamente para buscar medicamentos y tratamiento que al menos disminuyan o controlen la abundancia del virus en los pacientes. Es precisamente el estudio continuo de cómo el virus infecta nuestras células y cambia continuamente, lo que ha permitido mejorar el arsenal en la lucha contra el VIH. Por ejemplo, las drogas antiretrovirales (el VIH es un retrovirus), estuvieron a la vanguardia de los tratamientos contra el virus en los años 90. Estas drogas evitan que el virus se incorpore al genoma de la célula hospedera, que es el mecanismo que utiliza para poder reproducirse [12]. Estas medicinas fueron dadas inicialmente de forma individual, pero con el tiempo se han creado cocteles de varias drogas que son aún más efectivos en detener el avance desenfrenado del virus, lo que ha provocado que la enfermedad haya pasado de mortal a crónica y manejable en muchos casos [13].
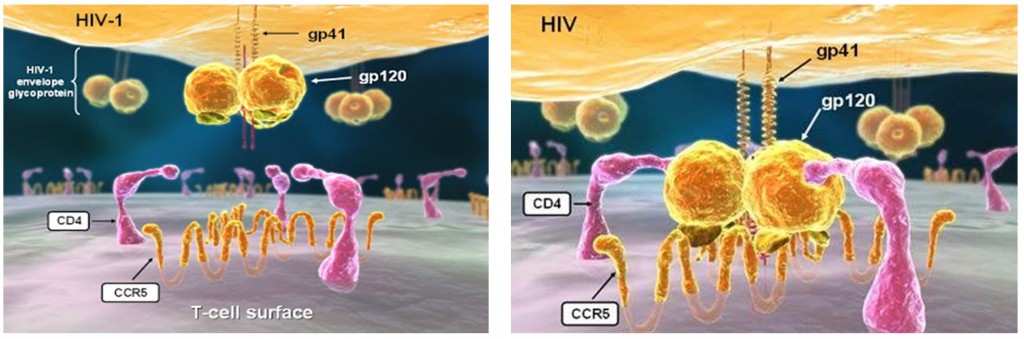
A pesar de que las drogas antiretrovirales permiten alargar la vida o controlar la enfermedad, no logran curarla. Sin embargo, hace unos años se encontró que un paciente en Berlin con VIH y que sufría de leucemia, recibió transplante de médula de un donante que tenía un defecto en un receptor mediante el cual el virus se ancla a las células para luego penetrar en ellas (la interacción entre virus y célula se hace como si el virus tuviera llaves en su superficie para candados o receptores en la superficie de la célula que es invadida – Figura 1), y luego del transplante el virus desapareció casi por completo del paciente [14].
Figura 1. Las proteínas llamadas gp41 y gp120 son las llaves que utiliza el virus para entrar a la célula. El receptor principal celular (llamado CD4) actua como el candado para que la llave viral se ancle. Tomado de: http://www.ebioworld.com/2012_07_01_archive.html.
Esto ha abierto un campo de investigación para alterar a propósito el gen que genera este receptor en los pacientes de SIDA (los genes tienen las instrucciones para construir estos receptores), lo que podría convertirse en un tratamiento efectivo; es algo así como dañar el candado para que la llave no entre. Es posible que con las nuevas tecnologías que han emergido en los últimos años, que permiten básicamente alterar cualquier gen que queramos [15–17] dañar estos candados celulares sea aún más sencillo. Por otra parte, el año pasado uno de los descubridores del virus, el Dr. Robert Gallo, y sus colaboradores, anunciaron las pruebas en humanos para una vacuna contra el VIH en la que han trabajado por más de una década [18]. Aunque suena prometedor, tendremos que esperar a que estas evaluaciones en humanos sean exitosas antes de ver si este también es un tratamiento posible.
El VIH continúa siendo uno de los más grandes flagelos de este siglo, pero los avances exponenciales de los grupos pioneros en investigación del virus, y las nuevas tecnologías de modificación de genes, junto con la tradicional terapia antiretroviral, dan esperanzas de que una cura pueda ser descubierta en un futuro no muy lejano.
Referencias
- AIDS.gov [Internet]. [cited 2016 Jun 16]. Available from: https://www.aids.gov/
- (CDC) C for DC& P. Pneumocystis Pneumonia — Los Angeles. Morb. Mortal. Wkly. Rep. 1981;30:250–2.
- Faria NR, Rambaut A, Suchard MA, Baele G, Bedford T, Ward MJ, et al. The early spread and epidemic ignition of HIV-1 in human populations. Science. 2014;346:56–61.
- Gao F, Bailes E, Robertson DL, Chen Y, Rodenburg CM, Michael SF, et al. Origin of HIV-1 in the chimpanzee Pan troglodytes troglodytes. Nature. 1999;397:436–41.
- (CDC) C for DC& P. Kaposi’s Sarcoma and Pneumocystis Pneumonia Among Homosexual Men. Morb. Mortal. Wkly. Rep. 1981;30:305–8.
- (CDC) C for DC& P. Pneumocystis carinii Pneumonia among persons with Hemophilia A. Morb. Mortal. Wkly. Rep. 1982;31:365–7.
- (CDC) C for DC& P. Opportunistic infections and Kaposi’s Sarcoma among Haitians in the United States. Morb. Mortal. Wkly. Rep. 1982;31:360–1.
- Gallo RC, Sarin PS, Gelmann EP, Robert-Guroff M, Richardson E, Kalyanaraman VS, et al. Isolation of human T-cell leukemia virus in acquired immune deficiency syndrome (AIDS). Science. 1983;220:865–7.
- Barré-Sinoussi F, Chermann JC, Rey F, Nugeyre MT, Chamaret S, Gruest J, et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS). Science. 1983;220:868–71.
- Rambaut A, Posada D, Crandall KA, Holmes EC. The causes and consequences of HIV evolution. Nat. Rev. Genet. 2004;5:52–61.
- Nora T, Charpentier C, Tenaillon O, Hoede C, Clavel F, Hance AJ. Contribution of recombination to the evolution of human immunodeficiency viruses expressing resistance to antiretroviral treatment. J. Virol. 2007;81:7620–8.
- Arts EJ, Hazuda DJ. HIV-1 antiretroviral drug therapy. Cold Spring Harb. Perspect. Med. 2012;2:a007161.
- Maartens G, Celum C, Lewin SR. HIV infection: Epidemiology, pathogenesis, treatment, and prevention. Lancet. Elsevier Ltd; 2014;384:258–71.
- Hütter G, Nowak D, Mossner Ma, Ganepola S, Müßig A, Allers K, et al. Long-Term control of HIV by CCR5 delta32/delta32 stem-cell transplantation. N. Engl. J. Med. 2009;360:692–7.
- Doudna JA, Charpentier E. The new frontier of genome engineering with CRISPR-Cas9. Science (80-. ). 2014;346:1258096–1258096.
- Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNA – guided DNA endonuclease in adaptative bacterial immunity. Science (80-. ). 2012;337:816–22.
- Gilbert LA, Larson MH, Morsut L, Liu Z, Brar GA, Torres SE, et al. CRISPR-mediated modular RNA-guided regulation of transcription in eukaryotes. Cell. Elsevier Inc.; 2013;154:442–51.
- AIDS pioneer finally brings AIDS vaccine to clinic [Internet]. Sci. News. [cited 2016 Jun 22]. Available from: http://www.sciencemag.org/news/2015/10/aids-pioneer-finally-brings-aids-vaccine-clinic?rss=1




Otra teoría dice que el SIDA pasó a la especie humana como resultado de una vacunación masiva contra el polio en el Congo, para la cual se utilizaron como sustrato de la vacuna chimpancés, presuntamente infectados con el virus.
Califica:
-
Me
gusta
0
- No me
gusta
0
Reportar